
Aunque hemos visto que existen carreteras de hielo por las que conducir, lo más normal es que los conductores intentemos evitar estas pistas de patinaje improvisadas. De ahí que cuando nieva, junto a la máquina quitanieve abriendo camino en el suelo blanco, suele ser frecuente encontrarnos con decenas de operarios con palas, moviendo de aquí para allá lo que desde lejos podría parecer más nieve.
Es sal, o cloruro sódico, que vierten sobre la carretera y los caminos. Los camiones la transportan desde almacenes cercanos y, al poco tiempo de haber cubierto la carretera con ella, la nieve y el hielo que quedaba empieza a desaparecer, a convertirse en agua que se desaloja a través de los laterales. ¿Por qué se echa sal para fundir el hielo? ¿Cómo funde la nieve la sal?
¿De qué está hecha la sal, o el agua?
Algunas personas tienen la impresión de que la sal, esparcida sobre hielo tanto en forma de polvo como en salmuera, es la encargada de derretirlo. Como si la reacción entre ambos fuese exotérmica (liberase calor), y fuese este el motivo por el que convierte nieve o hielo de nuevo en agua. No ocurre nada parecido, y ahí está la magia de la química: la temperatura no sube cuando se mezcla sal y agua.
Por un lado tenemos la sal o cloruro sódico (NaCl), una estructura cristalina no muy diferente de la que guardamos en casa para aliñar la comida, formada por átomos de sodio y cloro. Aunque la percibamos como un polvo (es un cristal pero se fractura con facilidad), mirada al microscopio forma una estructura en cuadrícula en la que se alternan átomos de sodio (Na) y cloro (Cl) de modo que cada uno de ellos está rodeado de seis átomos del otro. Así se ve en una mina, con sus impurezas de otros materiales, claro:
A nivel atómico, el cloro de la sal tiene carga negativa (Cl–) mientras que el sodio la tiene positiva (Na+). Como hay el mismo número de átomos de uno que de otro, el cristal o el polvo es neutro.
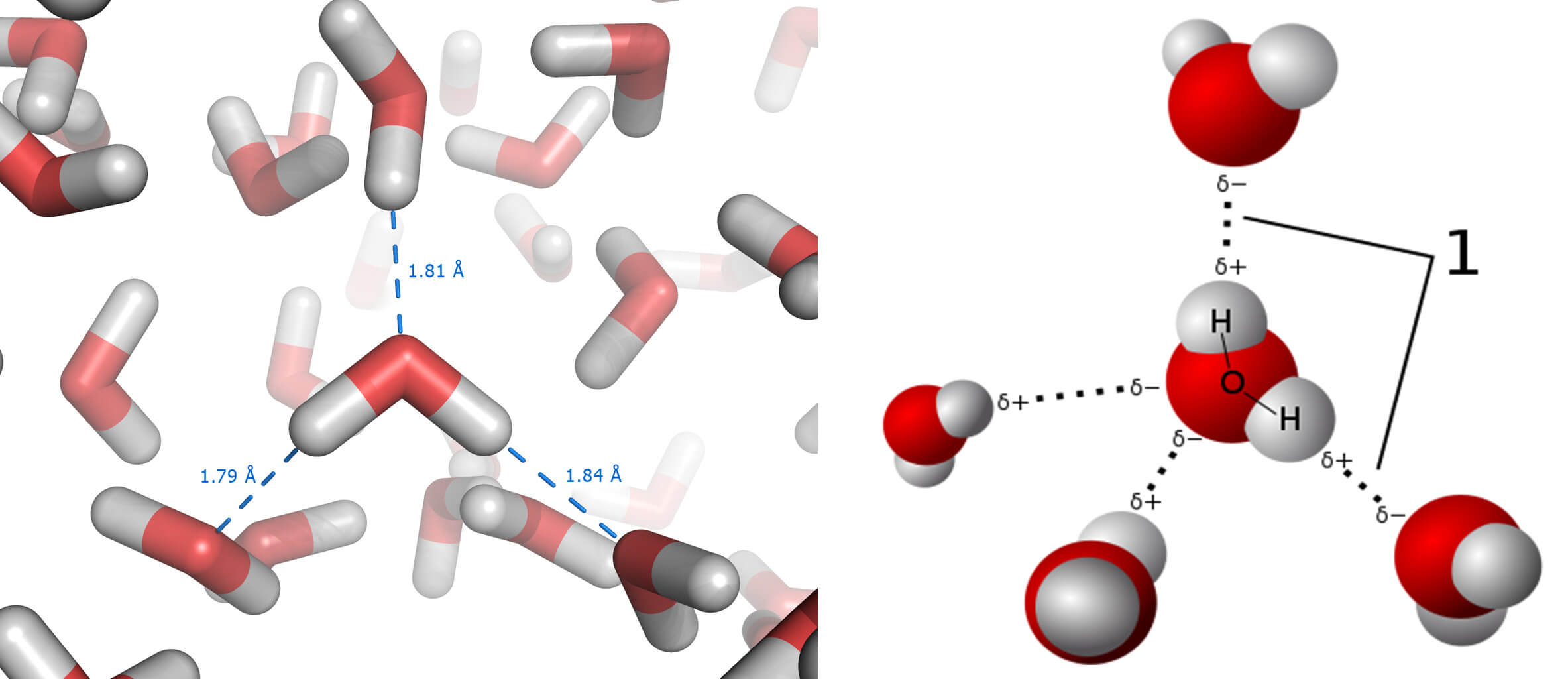
Por el otro lado está la conocida molécula del agua (H2O) que forma tanto el hielo como la nieve (que es hielo menos compacto). A pesar de conocerla bien, a menudo olvidamos los puentes de hidrógeno, un tipo de enlace formado entre el oxígeno de una molécula de agua y un hidrógeno de otra molécula de agua cercana como se ven abajo:
Y son importantes, ya que estos enlaces de hidrógeno dan al agua propiedades curiosas como los puntos de ebullición y fusión elevados (100ºC y 0ºC, respectivamente). La clave de cómo la sal derrite el hielo está justo en esta última cifra, y podremos comprobarlo en casa.
La sal no derrite el hielo, sino que se mezcla con él, bajando su punto de fusión
Hay un experimento muy interesante que podemos hacer en casa. En este, se cogen tres boles o recipientes iguales (mejor si son de plástico, o flexibles), se los llena de agua y se meten al congelador. Una vez se hayan helado por completo, los sacamos y hacemos lo siguiente:
- Al bol Nº1 lo dejamos sin tocar.
- Al Nº2 le echamos una capa fina de sal.
- Al Nº3 le echamos una capa fina de agua mezclada con sal (salmuera).
Y esperamos para ver cómo el tercero acaba mucho antes convertido en agua que el primero, y cómo el segundo tarda un tiempo intermedio. ¿Por qué ha pasado esto? La clave, invisible y a nivel atómico, está en los enlaces de hidrógeno. Vamos a acercarnos.
Cuando echamos sal en el segundo bol, ocurre que, en cuanto unas pocas moléculas de agua del hielo se funden, disuelven el cloruro de sodio (NaCl) en iones de sodio, (recordemos positivos, Na+) e iones de cloro (negativos, Cl–). Los iones de sodio atraen el oxígeno del agua, mientras que los iones de cloro atraen a los hidrógenos.
Eso hace que los puentes de hidrógenos entre moléculas de agua no puedan darse, y son estos los que elevaban la temperatura de fusión hasta los 0ºC. Si la temperatura de fusión baja, y lo hace hasta cerca de los -21ºC, entonces hace falta menos energía para fundir el hielo. Y este se transforma de nuevo en agua.
Con la salmuera (el tercer bol) ocurre algo similar, pero más rápido, ya que se parte de Na+ y Cl– que ya están disueltos en agua. Este es el motivo por el que a veces vemos camiones cisternas regando las carreteras con un líquido que funde el hielo. Este líquido es salmuera, y suele tener una concentración de al menos el 5% de NaCl disuelta. A nivel industrial, podemos aprovechar la salmuera resultante del proceso de desalinización para usarla en las carreteras heladas.
La importancia de la sal y el agua en el planeta
Las personas no hemos inventado nada, y este fenómeno lleva miles de millones de años dándose en nuestro planeta azul, cubierto de agua en tres cuartas partes de su superficie. ¿Por qué no se congela ese agua en zonas en las que se encuentra por debajo de los 0ºC?
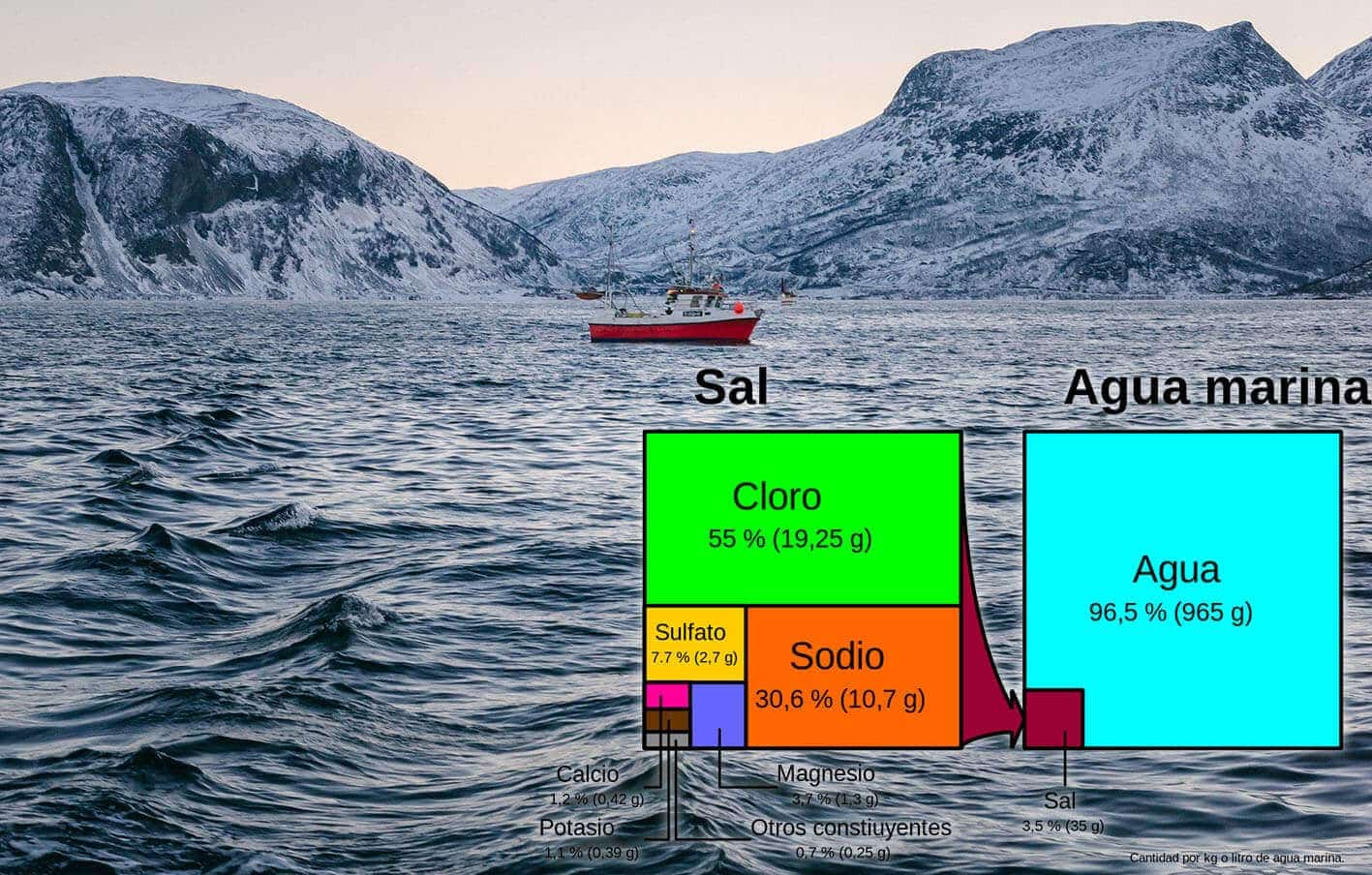
Haciendo uso de la misma pirueta química que hemos visto arriba, el cloro, sodio y otras sales disueltas en el agua de mar y oceánica (agua salada) reducen el punto de fusión de manera considerable. En los océanos, la cantidad de sales disueltas en el agua ronda el 3,5%, de las que cerca de un 85,6% es sal común (NaCl), un 7,7% sulfatos (CaSO4, Na2SO4, BaSO4…) y el resto otras sales.
Estas sales, arrastradas durante eones por los ríos a los lechos marinos, permiten océanos líquidos a bajas temperaturas. Sin ellas disueltas, la Tierra sería una bola de hielo yerma, por lo que tenemos bastante que agradecer a las sales disueltas.
Algunos lectores se preguntarán cómo es posible que sobre los océanos se viertan millones de toneladas anuales de sales de los ríos y que estos sigan siendo líquidos. Ocurre que bajo los océanos la corteza no es estática. Se genera en los labios de los volcanes submarinos, las dorsales oceánicas, y termina fundida eones después mediante un proceso llamado subducción, llevándose consigo las sales, de nuevo, al interior de la Tierra. De ahí que los océanos tiendan a un equilibrio entre agua dulce y sales.
Un equilibrio similar es el que hay que conseguir en las carreteras cuando empiezan a bajar las temperaturas, a caer la nieve y a formarse placas de hielo. Estas son peligrosas para la conducción, y pueden dejar zonas incomunicadas. Como vías de comunicación, es importante mantener las carreteras en buen estado de conservación, y esto incluye nevadas.
La mezcla de sales, tanto en forma sólida como en salmuera, es clave para conseguir la bajada del punto de ebullición del hielo, conservando las propiedades mecánicas de la carretera tales como el agarre entre el neumático y la vía.







Todavía no hay comentarios